辛格迪健康科技虚拟数据室(VDR):生命科学数据分享的专业之选
一、VDR核心优势:安全、高效、合规
(一)强大的安全保障
辛格迪 VDR 将文档存储于高度安全的数据中心,具备多重安全防护措施。可对用户的文件访问、打印等操作进行严格限制,即便用户已打开文件,也能随时撤消访问权限。同时,能精准跟踪记录用户在数据室的所有操作,还可应用个性化水印和定制保密协议(NDA),实现对文件的全方位保护,杜绝数据的复制、滥用和泄露风险,这是其他在线共享工具难以企及的。
(二)显著的效率提升与成本降低
VDR 支持用户通过安全加密网络在任何地点访问数据,实现高效共享与协作,助力交易快速达成。其操作便捷,可一键添加团队成员或合作伙伴,支持用户同时访问多个文件,通过拖拉即可完成多个文件和文件夹的上传 / 下载,还能设定文件访问时限。此外,使用 VDR 可减少不必要的旅行、文件快递延误,节省昂贵的印刷服务费用,提升平台使用效率,缩短交易时间,大幅降低企业的时间和金钱成本。
(三)高度的合规性
VDR 完全符合 NMPA、FDA、EMA 等法规要求,紧密集成 DMS 系统,DMS 内文件可直接拖拉至 VDR 实时分享。平台具备强大功能,能简化用户工作流程,支持跟踪供应商对文档的查看情况,内置搜索功能优化文件查找时间,新内容添加时用户可实时收到短信通知,为生命科学企业提供合规、便捷的解决方案。
二、VDR功能特性:全面满足业务需求
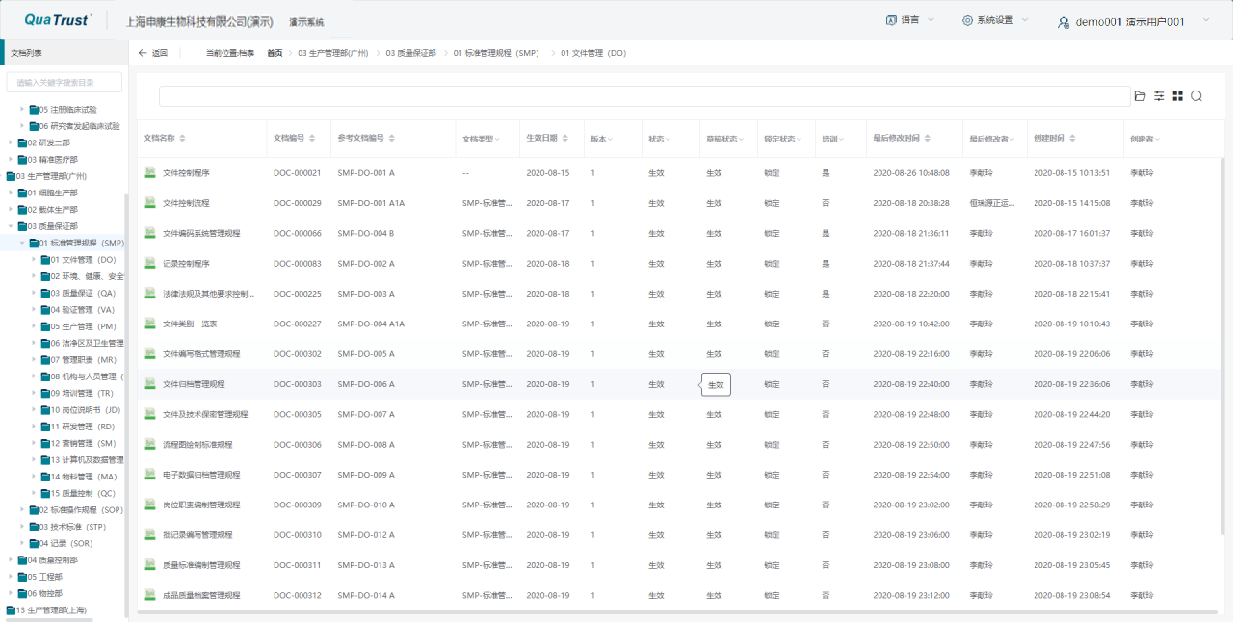
(一)文件管理与权限控制
VDR 提供清晰明了的目录和文件管理系统,支持电子文件管理,查找文件方便快速。权限控制严格,涵盖查看、下载、修订、审批、管理等多种权限,不同用户组拥有明确的权限划分,确保文件访问的安全性和规范性。
(二)水印保护与操作记录
具备强大的水印保护功能,包括实时水印(防盗拍)、生效时间水印和文件受控水印,有效保护机密核心文件。同时,能实时记录 VDR 内的所有操作,详细记录用户、操作类型、时间等信息,为审计和管理提供有力支持。
(三)移动端访问与审计管理
支持移动端访问,用户可通过手机等移动设备便捷登录平台,进行目录选择、文档查看等操作,满足移动办公需求。在审计管理方面,VDR 可提前准备审计资料,实现目录和文件的清晰展示;现场审计时,能根据审计官要求实时导入更多资料;审计官只能访问被授权的资料,确保审计过程的合规性和安全性,有效解决审计文件组织费时费力、查找麻烦、签署记录难以证实、文件版本更新不及时及机密文件易流失等痛点。
三、鲲泰数字化治疗管理系统(QMS):协同助力企业发展
除 VDR 外,辛格迪健康科技还推出鲲泰 ® 数字化质量管理系统(QMS),与 VDR 形成协同效应,进一步提升企业的质量管理和运营效率。
(一)文档管理
集成 CA 电子签名,实现全生命周期文档管理,支持离线打印、条码扫码,内置 GMP 流程、八级权限、电子审批等功能,保障文档管理的规范性和安全性。
(二)培训管理
提供完整的在线培训和课件管理,涵盖课程计划、课件管理、题库管理、证书管理、学习提醒等功能,支持移动端学习,助力企业提升员工素质。
(三)偏差、CAPA、变更、审计、投诉管理
偏差管理融入优秀管理精髓,贴合中国企业管理要求,实现流程自动化和任务提醒;CAPA 管理支持多种事件来源,确保 CAPA 的可执行性;变更管理支持业务、生产、项目等多方面变更,实现流程自动化和风险评估;审计管理支持内外部审计过程,自动任务分配,跟进审计发现;投诉管理支持内外部对产品、流程、服务等方面的投诉,整合 CAPA,符合相关法规要求。
四、适用场景与价值
辛格迪 VDR 适用于生命科学企业的产品研发、协同工作和资本运作等场景,在政府及监管机构对患者数据严格保护的要求下,能帮助企业优化数据沟通及对外分享方式,保护企业核心信息,实现数据的轻松共享、控制和跟踪。鲲泰 ®QMS 则全面支持企业的质量管理,提升企业的合规性和运营效率。
作为生命科学企业数字化解决方案的领导者,辛格迪健康科技致力于为企业提供专业、可靠的产品和服务。如需了解详细方案,欢迎联系上海辛格迪健康科技团队。